← Accueil >> Recherche >> Projets en cours >> Essai ANRS 12372 Moderato
Recherche
Titre
Essai clinique randomisé, de non infériorité, comparant une stratégie de « bithérapie de maintenance » par dolutegravir + lamivudine (DTG/3TC) ou atazanavir/ritonavir + lamivudine (ATV/r+3TC) à la « trithérapie de référence » OMS par ténofovir + emtricitabine ou lamivudine + efavirenz (TDF+3TC+EFV) en Afrique de l’ouest et centrale.
Promoteur
Inserm-ANRS
Institut National de la Santé et de la Recherche Médicale
ANRS Maladies Infectieuses Emergentes – Agence autonome de l’Inserm (ANRS)
Investigateurs coordonnateurs
- Pr Serge Paul Eholié, SMIT, CHU de Treichville, Université Felix Houphouët Boigny, Abidjan, Côte d’Ivoire
- Dr Roland Landman, IMEA-CHU Bichat Claude Bernard SMIT, Paris, France
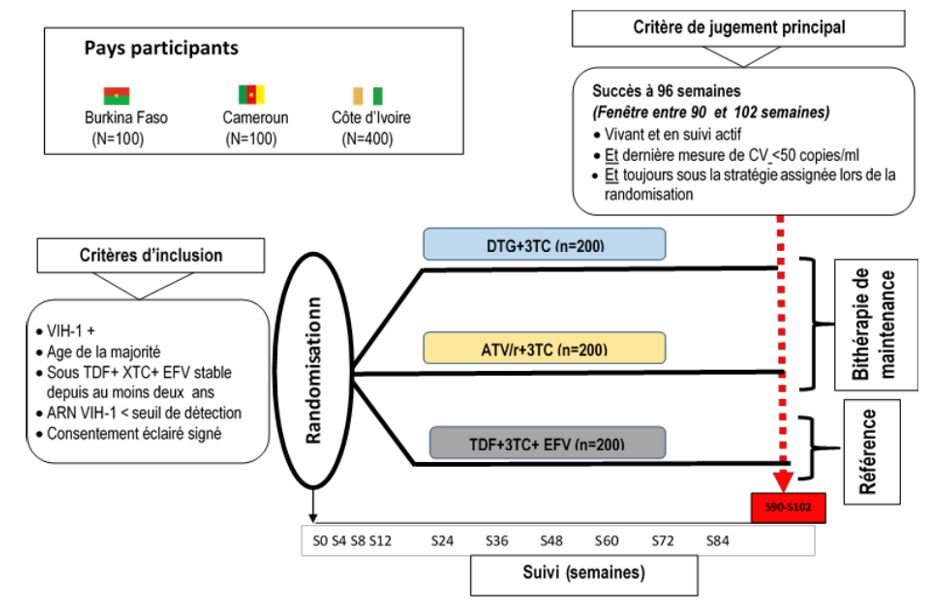
Pays participants
Burkina-Faso, Cameroun, Côte d’Ivoire
Objectif principal
Chez des patients en première ligne de traitement ARV par TDF+XTC+EFV en succès virologique (charge virale < seuil de détection de la technique utilisée) depuis au moins deux ans: démontrer la non infériorité à 96 semaines d’une stratégie de passage en bithérapie de maintenance (à base soit de DTG+3TC soit de ATV/r+3TC) comparée à la stratégie qui consiste à poursuivre la trithérapie de référence OMS par TDF+3TC+EFV.
Objectifs secondaires
Comparer la stratégie de passage en bithérapie de maintenance à la stratégie de poursuivre de la trithérapie de référence sur les critères suivants :
- Le succès virologique et sa durabilité
- La survenue de nouvelles mutations de résistances du VIH-1
- Le maintien de l’immunité
- La morbidité sévère
- La tolérance globale
- La tolérance rénale
- La tolérance neurologique
- La tolérance osseuse
- La tolérance hépatique
- L’observance aux traitements
- La qualité de vie
- Les concentrations plasmatiques des antirétroviraux chez les personnes en échec
- Le bénéfice économique
Comparer les 3 régimes ARV utilisés dans l’essai (i.e. : chaque bithérapie utilisée dans la stratégie de maintenance à la trithérapie utilisée dans la stratégie de référence, puis les bithérapies utilisées dans la stratégie de maintenance entre elles) sur les mêmes critères principal et secondaire que ceux qui ont servi aux comparaisons de stratégies.
Comparer les 2 régimes ARV utilisés dans la stratégie de bithérapie de maintenance sur le critère suivant :
- Retour à une trithérapie
Type d’essai
Il s’agit d’un essai clinique de non infériorité de phase III, randomisé, sans insu sur le traitement, multicentrique, en Afrique de l’Ouest et du Centre.
Stratégie de randomisation et d’analyse par stratégie et par régime
Il s’agit d’un essai avec deux stratégies (bithérapie de maintenance et trithérapie de référence) et trois régimes ARV (DTG+3TC et ATV/r+3TC, utilisés dans la stratégie de bithérapie de maintenance et TDF+3TC+EFV utilisé dans la stratégie de trithérapie de référence).
L’analyse principale comparera les deux stratégies.
Des analyses secondaires compareront les trois régimes ARV deux à deux.
Pour permettre ces analyses secondaires, les participants seront assignés par tirage au sort à l’inclusion à chacun des trois régimes ARV (bras 1 : DTG+3TC ; bras 2 : ATV/r+3TC ; bras 3 : TDF+3TC+EFV) avec une répartition équilibrée 1 :1 :1. La stratégie de bithérapie de maintenance inclura les bras 1 et 2. La stratégie de trithérapie de référence inclura le bras 3.
Nombre de participants nécessaires : 600 (200 par régime ARV, soit 400 dans la stratégie de bithérapie de maintenance et 200 dans la stratégie de trithérapie de référence)
Critère de jugement principal
Le critère de jugement principal est le succès à 96 semaines.
Le succès sera décrit et analysé en suivant l’algorithme snapshot de la FDA (voir Annexe D: algorithme snapshot de la FDA), c’est-à-dire que:
- Seront considérées en succès, les personnes ayant la dernière CV< 50 copies/mL dans la fenêtre d’analyse autour de 96 semaines (90 à 102 semaines), et étant restées jusqu’au bout dans la stratégie de l’essai.
- Seront considérées en échec, les personnes ayant la dernière CV≥ 50 copies/mL dans la fenêtre d’analyse autour de 96 semaines (90 à 102 semaines), ou n’ayant pas de CV dans la fenêtre d’analyse ou n’étant pas restées jusqu’au bout dans la stratégie de l’essai.
Maintien ou arrêt de la stratégie de l’essai :
Pour les personnes tirées au sort pour suivre la stratégie de bithérapie de maintenance (à base soit de DTG+3TC soit de ATV/r +3TC), le maintien dans la stratégie de l’essai est le maintien en bithérapie par l’un ou l’autre de ces régimes ARV. Le passage d’un régime à l’autre est considéré comme un maintien dans la stratégie. Le passage vers tout autre régime ARV est considéré comme l’arrêt de la stratégie, sauf si ce passage est motivé par la survenue d’une grossesse ou la nécessité d’un traitement antituberculeux*.
Pour les personnes tirées au sort pour suivre la stratégie de trithérapie de référence : le maintien dans la stratégie de l’essai est le maintien en trithérapie par TDF+3TC+EFV. Le passage vers tout autre régime ARV est considéré comme l’arrêt de la stratégie,
sauf si ce passage est motivé par la survenue d’une grossesse ou la nécessité d’un traitement antituberculeux*.
* Cette exception est motivée par un contexte où ces événements sont probables, les décisions de modification de régime ARV risquant de défavoriser d’emblée la stratégie de maintenance pour des raisons de précautions liées aux molécules utilisées, et non pour des raisons d’efficacité du contrôle virologique.
Critères de jugement secondaires
Les critères de jugement secondaires sont :
- Pourcentage de participants qui atteignent une des composantes du critère combiné suivant entre J0 et S96: « émergence de virus résistant », « baisse d’au moins 20% de la clairance de la créatinine » ou « troubles neuropsychiques de grade 3-4 » (ce critère est le critère de jugement secondaire pour lequel l’analyse disposera de plus de puissance)
- Evolution de la charge virale VIH-1 entre J0 et S96
- Evolution du pourcentage de personnes en succès virologique (CV< 50 copies/mL) entre J0 et S96
- Evolution du nombre et du pourcentage des lymphocytes CD4 entre J0 et S96
- Pourcentage des personnes en échec virologique ayant des virus présentant des nouvelles mutations de résistance à S48 et S96 par rapport à S0
- Profil des nouvelles mutations de résistance du VIH-1 constatées à S48 et S96 chez les personnes en cas d’échec virologique
- Incidence de morbidité de stade OMS 3-4 entre J0 et S96 (évènements classant SIDA et morbidité sévère non liée au SIDA)
- Incidence de morbidité de grade ANRS 3-4 entre J0 et S96 (tolérance)
- Incidence de morbidité de grade ANRS 3-4 rénale entre J0 et S96
- Incidence de morbidité de grade ANRS 3-4 neurologique entre J0 et S96
- Incidence de morbidité de grade ANRS 3-4 hépatique, anomalies ou trouble de la fonction hépatique entre J0 et S96
- Evolution de la clairance de la créatinine entre J0 et S96
- Evolution du pourcentage de patients ayant une anomalie rénale de grade 1,2,3 ou 4 entre J0 et S96
- Evolution du pourcentage de patients ayant une anomalie hépatique de grade 1,2,3 ou 4 entre J0 et S96
- Evolution du pourcentage de patients ayant une anomalie neuropshychique de grade 1,2,3 ou 4 entre J0 et S96
- Evolution de la densité osseuse mesurée par ostéodensitométrie entre J0 et S96
- Evolution de l’adhérence aux traitements mesurée par autoquestionnaire entre J0 et S96
- Evolution de la qualité de vie mesurée par le questionnaire ProQOL entre J0 et S96
- Evolution des symptômes ressentis mesurée par l’autoquestionnaire entre J0 et S96
- Cout-efficacité des stratégies (voir le protocole spécifique de cette sous-étude)
- Concentration plasmatique d’ARV chez les personnes en échec virologique
- Pourcentage de patients sous bithérapie étant revenu à une trithérapie entre J0 et S96
Population de l’essai
Critères d’inclusion :
- Infection documentée au VIH-1
- Age de la majorité dans le pays participant
- CD4 > 200 cellules/mm3 à la pré-inclusion
- Démarrer un traitement ARV de première ligne à base d’inhibiteurs non nucléotidiques de la transcriptase inverse dont le TDF+XTC+EFV depuis au moins deux ans, sans antécédent d’échec virologique.
- Absence d’antécédent d’échec virologique, défini par au moins un ARN VIH-1 ≥ au seuil de détection de la technique utilisée (seuil à préciser) au moment de la réalisation du test (deux blips entre 50 et 200 copies/mL sont néanmoins autorisés).
- Au moins deux ARN VIH-1 consécutives < au seuil de détection de la technique utilisée (seuil à préciser), au cours des deux années précédant l’inclusion, incluant la charge virale à la pré-inclusion.
- Pour les femmes à potentiel de grossesse, engagement à suivre une méthode de contraception efficace pendant toute la durée du suivi dans l’étude
- Consentement éclairé signé par le patient
Critères de non inclusion :
- Infection par le VIH-2 ou VIH-1+2
- Nadir des CD4 <100 cellules/mm3
- Hépatite chronique B (Ag HBs positif dans le bilan de préinclusion)
- Tuberculose pulmonaire active en cours de traitement
- Infection opportuniste en cours d’évolution
- Chimiothérapie ou immunothérapie en cours
- Anomalie biologique de grade > 2 sur les paramètres usuels de la numération formule sanguine : taux d’hémoglobine, neutrophiles, plaquettes
- ALAT≥ 3 x la limite supérieure de la normale, ou critères d’insuffisance hépatique sévère
- Clairance de la créatinine < 50 ml/min (formule CKD-EPI)
- Allergie à un des médicaments de l’étude ou à leurs composants
- Prise de traitements contre-indiqués avec les médicaments de l’étude Grossesse en cours ou refus de contraception
- Personne à risque de non compliance
- Tous symptômes ou toutes valeurs biologiques évoquant un trouble systémique (rénal, hépatique, cardio-vasculaire, pulmonaire) ou toutes autres affections médicales qui pourraient interférer avec l’interprétation des résultats de l’essai ou compromettre la santé des patients
Intervention
Le jour de l’inclusion, les personnes seront affectées par tirage au sort à un des trois groupes suivants :
- Bras 1 DTG+3TC : bithérapie par dolutégravir (50mg) + lamivudine (300mg) en une prise ¨par jour.
- Bras 2 ATV/r+3TC : bithérapie par atazanavir (300 mg) boosté avec du ritonavir (100 mg) + lamivudine (300 mg) en une prise par jour.
- Bras 3 TDF+3TC+EFV : trithérapie par tenofovir 245 mg + lamivudine (300 mg) + efavirenz (400 mg) en une prise par jour.